SLCトランスポーター創薬
当社は、SLCトランスポーターの中から医薬品のターゲットとして有望なトランスポーターを絞り込み、その機能や構造を解析することで、創薬に繋げています。
SLC(Solute Carrier)トランスポーターは細胞膜に存在するタンパク質で、グルコースやアミノ酸など生体の維持に必須な有機物質を効率的に細胞内に輸送します。現在までに400種類以上のSLCトランスポーター遺伝子が同定され、がん・自己免疫疾患・代謝性疾患・神経変性疾患などの疾患の治療標的として研究が進められています。
SLCトランスポーターの例
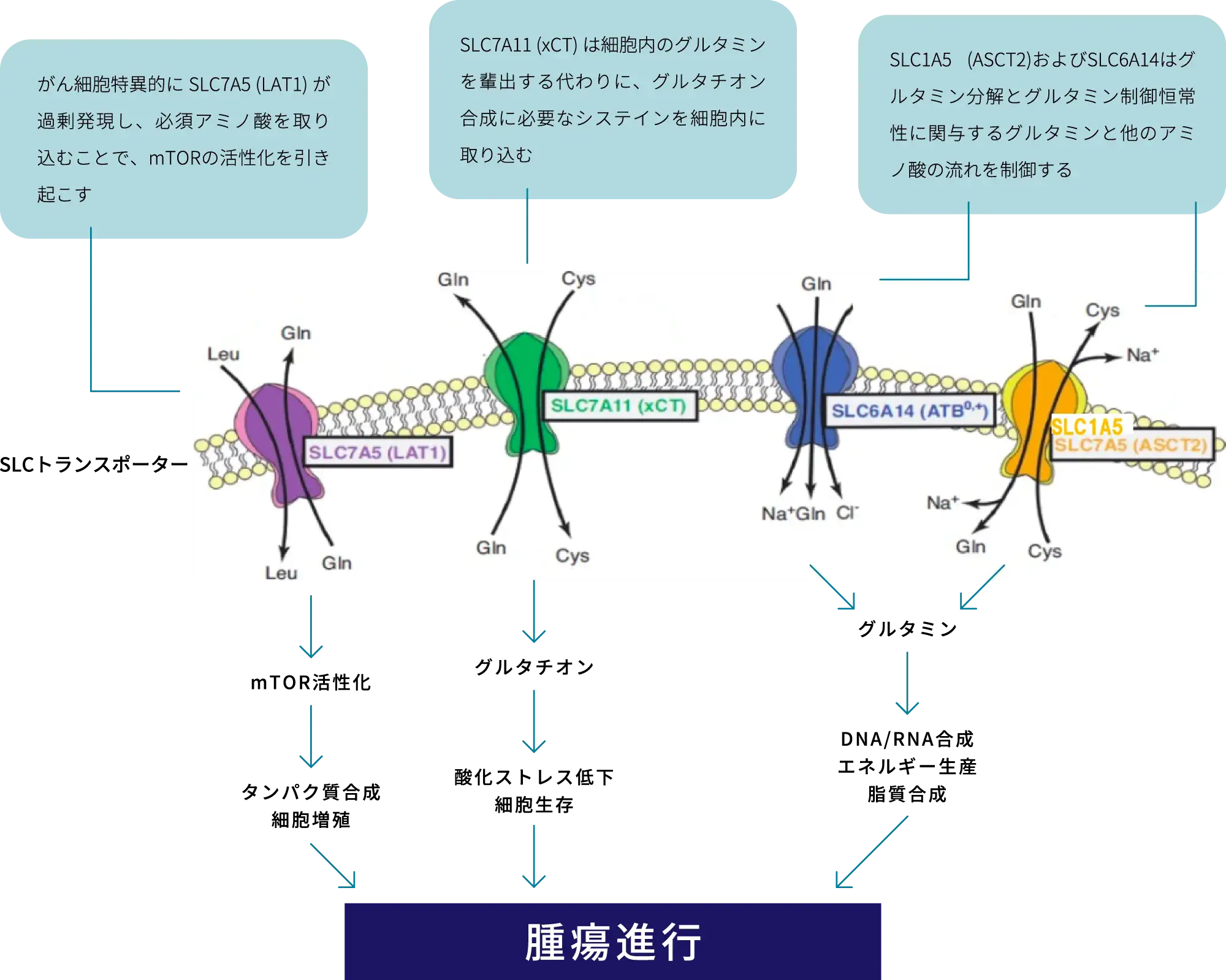
SLCトランスポーターは様々な疾患の治療標的として考えられてきたものの、SLCトランスポーターの多種多様な機能や複雑な分子構造が最近まで明らかになっていなかったため、SLCトランスポーターを標的とした医薬品の開発はあまり進んできませんでした。そのため、米国FDA承認薬の標的遺伝子になっているのは、400種類以上の同定されたSLCトランスポーターのうち13種に限られ、米国FDAが承認した医薬品の標的遺伝子に占める割合は5%未満(2017年時点データに基づく)と非常に少ない状況にあります。一方で、近年の構造解析や計算生物学等の進歩により隠されていたSLCトランスポーターの機能の解明が急速に進み、薬剤の開発が可能になってきました。

このように近年開発が加速し始めたSLCトランスポーター標的治療薬ですが、当社では1993年に創業者がSLCトランスポーターの研究を開始して以降、その研究を継続・発展し続けてきた結果、SLCトランスポーター創薬のトップランナーと言える研究開発結果を築いてきており、更にその創薬技術をプラットフォームとして発展・構築してきました。
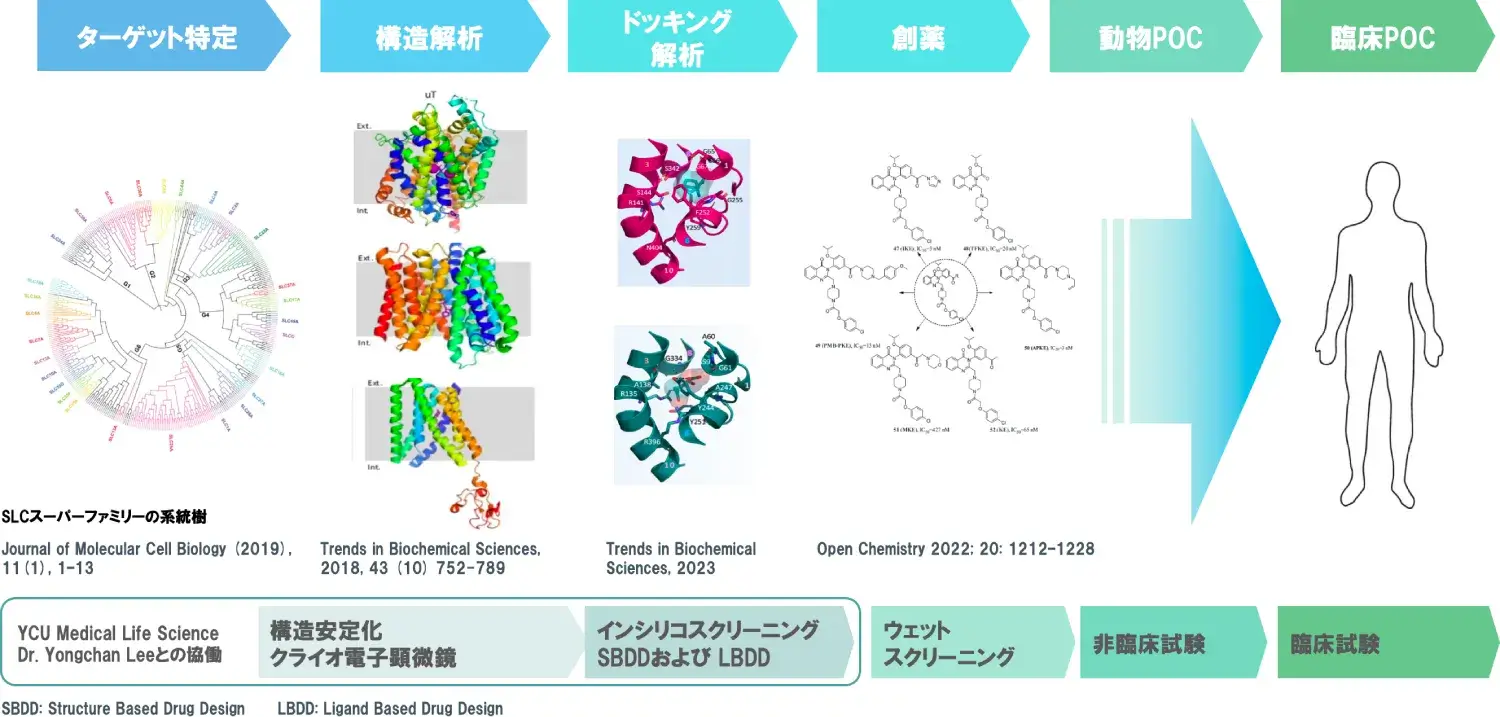
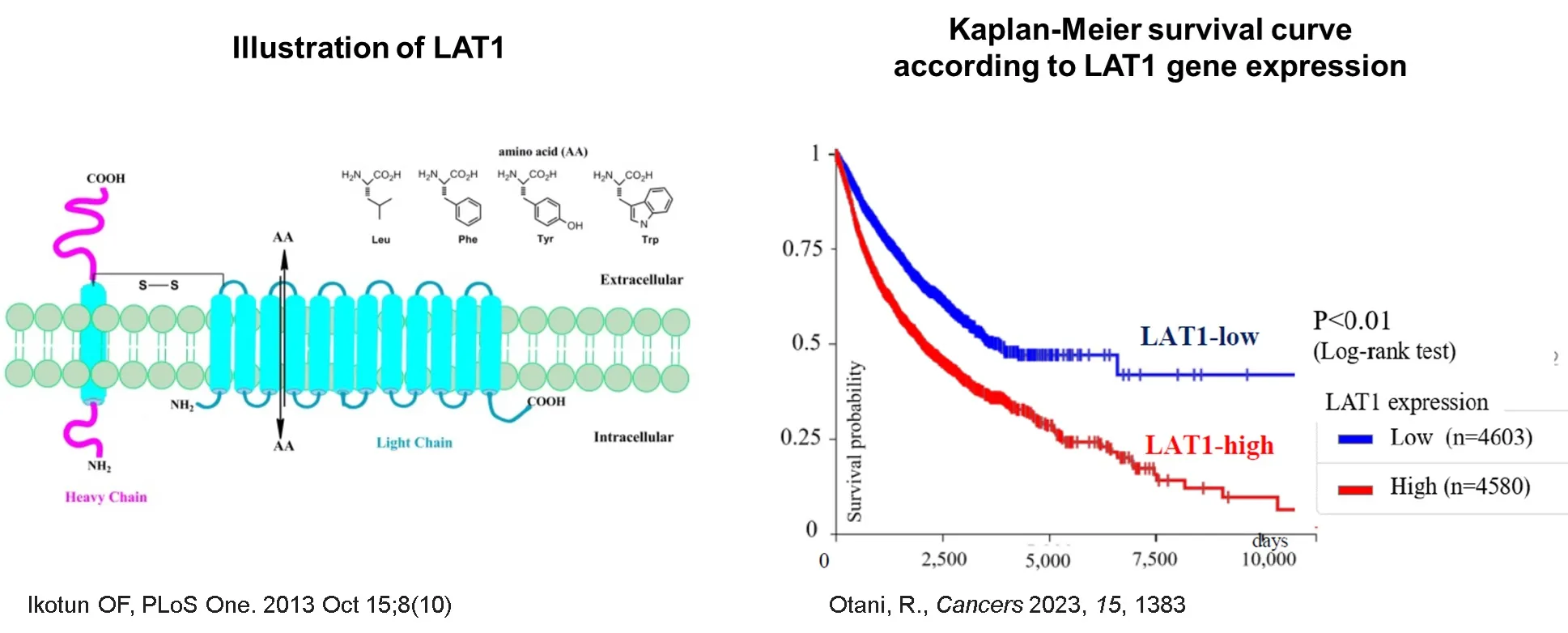
当社創業者は、生理学的および病理学的プロセスに関与する61種類のアミノ酸トランスポーターを評価することで、1998年にLAT1(がん特異性必須アミノ酸トランスポーター)、2002年にはURAT1(高尿酸血症の原因を明らかとする尿酸トランスポーター)の分子同定をしております。その内まずはLAT1に注力をして研究を進め、2003年にはLAT1を選択的に阻害するナンブランラトを発見し、2015年にナンブランラトの国内第1相試験を開始、2022年に国内第2相試験(胆道がん2次以降療法)を完了し、その効果と安全性を実証しました。
ナンブランラトの研究開発を進める中で、2019年にはクライオ電子顕微鏡によるLAT1とCD98の複合体構造の解明を横浜市立大学との共同研究により達成しました。LAT1の分子集合とアミノ酸輸送のメカニズムは不明点が多かったため、この構造解明は今後の創薬の可能性を大きく発展させるものでした。この構造解明ではLAT1は正準LeuTフォールドを特徴とする一方、膜貫通へリックス6上に特異なループ構造を示し、疎水性アミノ酸や薬剤を収容するための拡張キャビティを形成していることが明確になりました。また、CD98hcは細胞外ドメインと膜貫通ドメインだけでなく、ドメイン間リンカーでも複数の相互作用を介してLAT1に関与していることも解明されました。
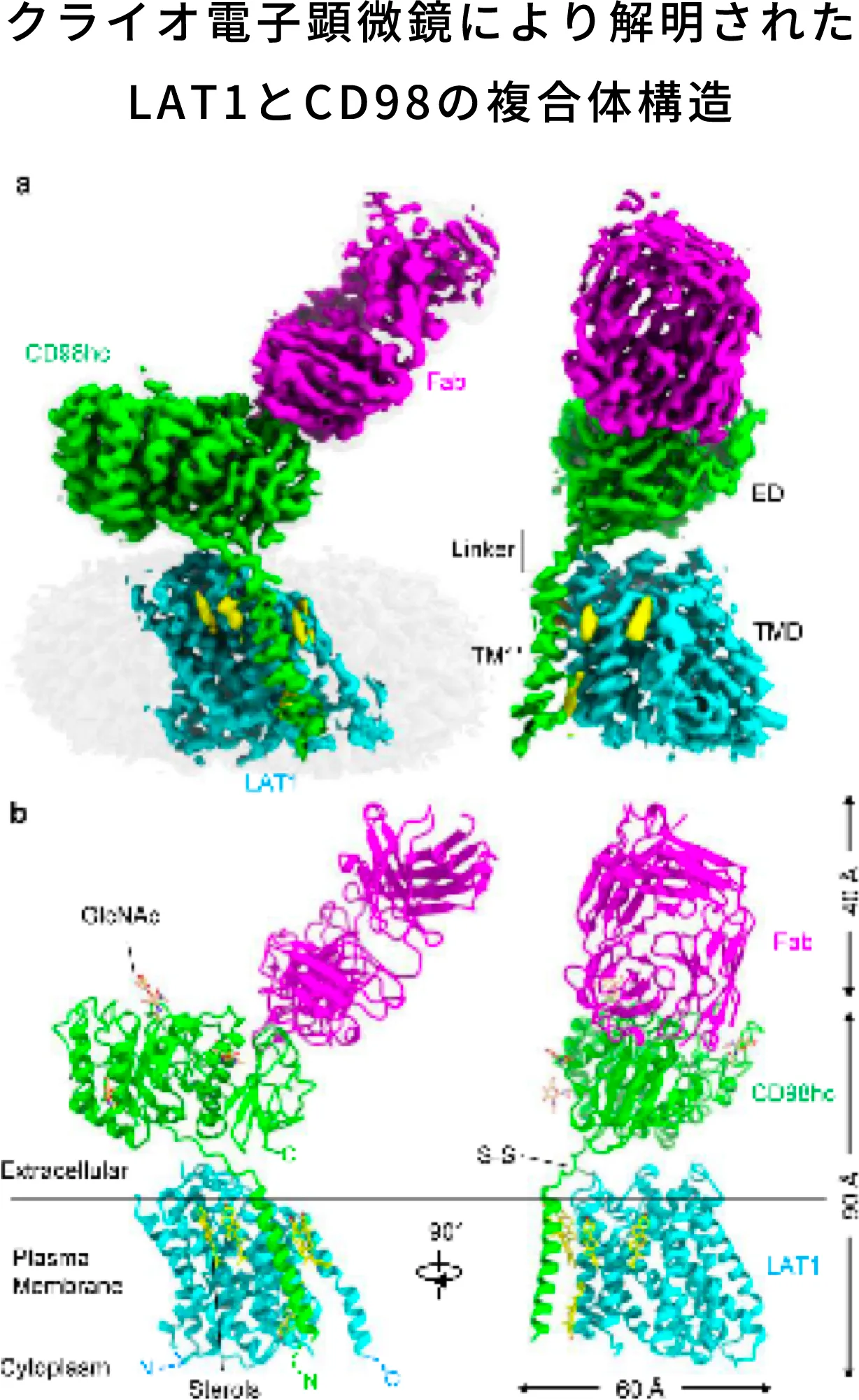
Lee, Y., Nat Struct Mol Biol 26, 510–517 (2019)
現在は、開発中であるナンブランラトとJPH034のLAT1阻害剤2剤に加え、次の LAT1阻害剤の候補化合物を見出しており、さらに抗がん剤のターゲットとして期待できる次のSLCトランスポーターについても創薬研究を開始しています。
LAT1阻害剤
SLCトランスポーターのひとつで、当社創業者が1998年に発見したLAT1(L型アミノ酸トランスポーター1)は、大型中性アミノ酸を輸送するトランスポーターであり、がん細胞の増殖や自己免疫疾患における免疫細胞の活性化などに寄与していることが確認されています。
LAT1が関連することが確認されている疾患
| がん | 自己免疫疾患・その他 |
|---|---|
| 胆道がん、大腸がん、腎臓がん、膵臓がん、脳腫瘍、乳がん、甲状腺がん | 多発性硬化症、全身性エリテマトーデス、慢性神経障害性疼痛、網膜血管新生、アトピー性皮膚炎、炎症 |
がん治療とLAT1
LAT1は様々な固形がんで過剰発現し、LAT1が多く発現する程、生存期間が短いことが知られています。細胞が、がん化したり急速に増殖し始めると、細胞膜上のLAT1の発現が亢進し、その結果アミノ酸の摂取量が増加し、細胞は爆発的に増殖します。 LAT1の発現は、リンパ節転移、細胞増殖、血管新生、および生存期間の短縮と密接に関連しています。
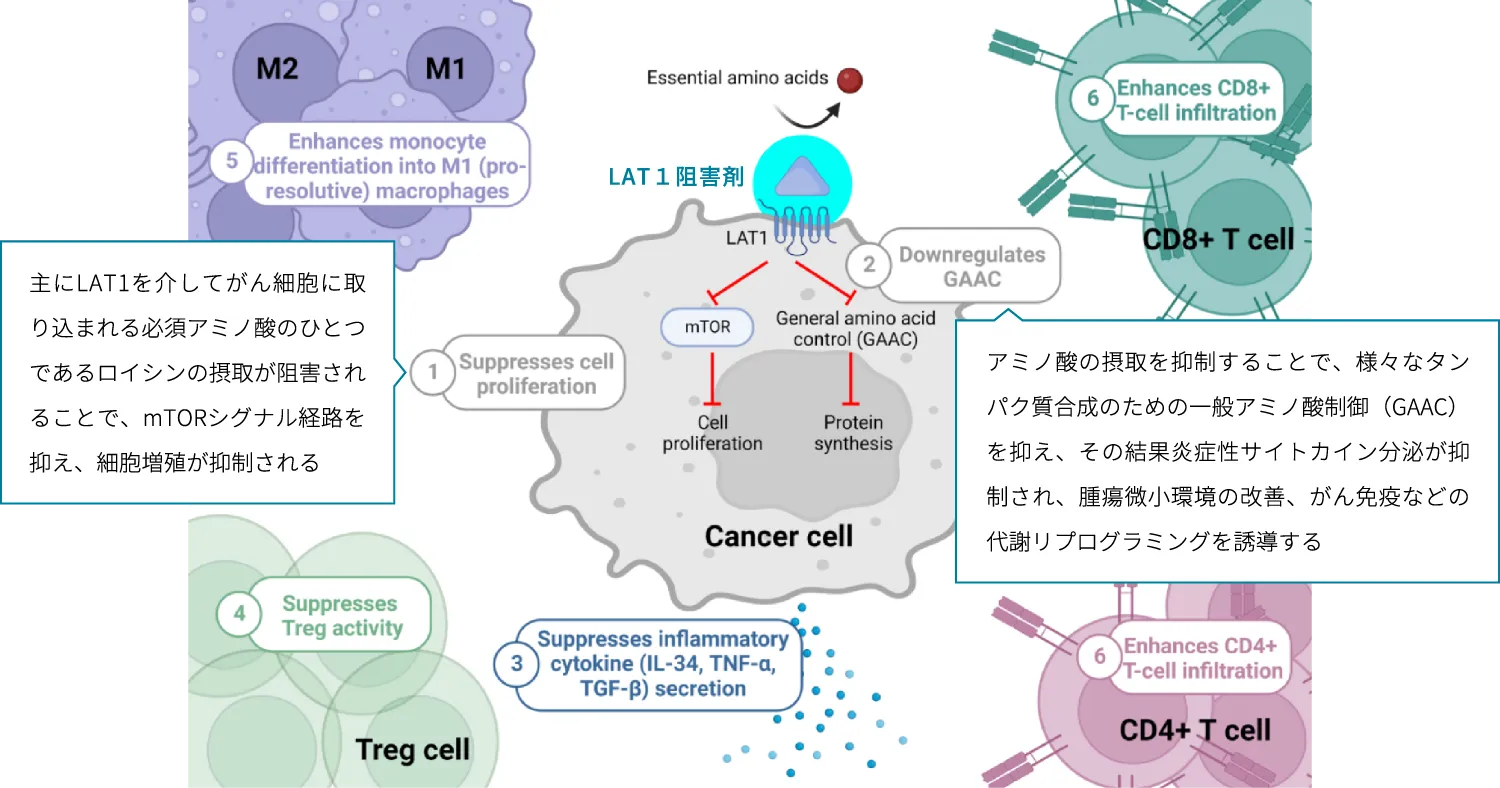
LAT1阻害剤は、がん細胞によるLAT1を介したアミノ酸の摂取を阻害することにより、複数の経路でがん細胞の増殖抑制効果をもたらすことができると考えられています。
自己免疫疾患治療とLAT1
免疫細胞が活性化されると、LAT1が表面に集まりアミノ酸を大量に取り込み、炎症性のサイトカインを放出して炎症の起爆剤になります。LAT1は、リンパ球・マクロファージ・樹状細胞・B細胞等が活性化された時にだけ発現すると報告されています。このLAT1の働きをLAT1阻害剤により阻害することで、炎症が抑制されることにより、様々な自己免疫疾患の治療に繋がると考えられます。
学会・論文発表
当社の学会・論文発表、及び主要な関連論文
米国臨床腫瘍学会消化器がんシンポジウム(Gastrointestinal Cancers Symposium : ASCO GI 2023)
口頭発表 胆道がん2次療法(3次以降含む)適応とした国内第2相臨床試験主要評価項目結果
<リンク:https: //ascopubs.org/doi/abs/10.1200/JCO.2023.41.4_suppl.494?af=R>
米国臨床腫瘍学会年次総会(2023 ASCO Annual meeting) Clinical Science Symposium 口頭発表 胆道がん2次療法(3次以降含む)適応とした国内第2相臨床試験サブグループ解析結果
<リンク:https://ascopubs.org/doi/10.1200/JCO.2023.41.16_suppl.4011>
Kaira et al., Clinical significance of L-type amino acid transporter 1 expression as a prognostic marker and potential of new targeting therapy in biliary tract cancer. BMC Cancer 2013, 13, 482
<リンク:https: //bmccancer.biomedcentral.com/articles/10.1186/1471-2407-13-482>
Supak et al., Inhibition of l-type amino acid transporter 1 activity as a new therapeutic target for cholangiocarcinoma treatment, Tumor Biology 2017 Mar;39(3) 1-14
<リンク:https://pubmed.ncbi.nlm.nih.gov/28347255/>
Nobuyuki et al., High expression of L-type amino acid transporter 1 as a prognostic marker in bile duct adenocarcinomas, Cancer Medicine 2014; 3(5): 1246–1255
<リンク:https://www.ncbi.nlm.nih.gov/pmc/articles/PMC4302674/>
Palanivel et al., Oncogenic KRAS mutations enhance amino acid uptake by colorectal cancer cells via the hippo signaling effector YAP1, Mol. Oncol. 2021; 15. 2782–2800
<リンク:https://pubmed.ncbi.nlm.nih.gov/34003553/>
Arafath et al., The amino acid transporter SLC7A5 is required for efficient growth of KRAS-mutant colorectal cancer, Nature Genetics 2021 Jan; 53 (16) 16–26
<リンク:https://pubmed.ncbi.nlm.nih.gov/33414552/>
Ainara et al., HIF2α acts as an mTORC1 activator through the amino acid carrier SLC7A5, Molecular Cell 2012 Dec 14;48(5), 681–691
<リンク:https://pubmed.ncbi.nlm.nih.gov/23103253/>
Kosuke et al., Characterization of the expression of LAT1 as a prognostic indicator and a therapeutic target in renal cell carcinoma, Sci Rep. 2019 Nov 20;9(1): 16776
<リンク:https://pubmed.ncbi.nlm.nih.gov/31748583/>
Altan et al., Relationship between LAT1 expression and resistance to chemotherapy in pancreatic ductal adenocarcinoma. Cancer Chemotherapy and Pharmacology 2018; 81. 141–153.
<リンク:https://pubmed.ncbi.nlm.nih.gov/29149426/>